Deterioro Cognitivo

Introducción
El entrenamiento cognitivo se basa en la premisa de que las habilidades cognitivas, como la memoria, la atención y la resolución de problemas, pueden mejorarse mediante ejercicios sistemáticos y estructurados. Uno de los primeros estudios sobre entrenamiento cognitivo fue realizado por Alfred Binet y Théodore Simon a principios del siglo XX, quienes desarrollaron los primeros tests de inteligencia, lo que sentó las bases para comprender y mejorar las habilidades mentales.
En las décadas siguientes, investigadores como Jean Piaget y Lev Vygotsky profundizaron en la comprensión del desarrollo cognitivo, proponiendo teorías sobre cómo los niños aprenden y desarrollan habilidades mentales a través de la interacción con su entorno. En las décadas de 1960 y 1970, la neurociencia comenzó a influir significativamente en el aprendizaje, permitiendo a los científicos observar los cambios cerebrales ante el aprendizaje y la experiencia. Investigadores como Merzenich demostraron la plasticidad cerebral y la capacidad del cerebro para reorganizarse y formar nuevas conexiones neuronales frente a desafíos cognitivos.
En los años 80 y 90, el concepto de entrenamiento cognitivo como una intervención formal comenzó a consolidarse, con programas como el «Instrumental Enrichment Programme» de Feuerstein, enfocados en mejorar habilidades cognitivas mediante actividades estructuradas. Al mismo tiempo, el desarrollo de software educativo y videojuegos cognitivos hizo el entrenamiento cognitivo más accesible y atractivo. Sin embargo, los estudios sobre la efectividad de estos programas han mostrado resultados mixtos, algunos señalando mejoras en habilidades específicas y en la plasticidad cerebral, mientras que otros no han demostrado una eficacia significativa.
Una técnica emergente con el potencial de mejorar el entrenamiento cognitivo es la estimulación magnética transcraneal de baja intensidad (Li-TMS). Li-TMS es una técnica no invasiva eficaz para modular la actividad cerebral y mejorar diversas funciones cognitivas. Se utiliza para tratar condiciones neuropsiquiátricas como la depresión resistente al tratamiento y los trastornos de ansiedad, aplicando pulsos magnéticos repetitivos sobre el cuero cabelludo para estimular áreas específicas del cerebro. Li-TMS ha demostrado mejorar habilidades cognitivas, como memoria, atención y percepción, mediante efectos oscilatorios inducidos que favorecen tareas cognitivas según su interacción con las oscilaciones funcionales cerebrales.
Además, Li-TMS induce plasticidad sináptica similar a la potenciación a largo plazo (LTP), con efectos que se extienden más allá del periodo de estimulación. Estos resultados son prometedores para mejorar habilidades motoras, y la combinación de Li-TMS con coactivación cortical durante tareas potencia los efectos Hebbian sobre el aprendizaje de habilidades.
En aplicaciones terapéuticas, Li-TMS es útil para mejorar la neuroplasticidad y facilitar la rehabilitación tras un accidente cerebrovascular o una lesión cerebral traumática. También mejora funciones cognitivas como la memoria y el lenguaje en adultos mayores con deterioro cognitivo. Li-TMS optimiza el rendimiento humano en entornos laborales complejos, mostrando que la inhibición de ciertos procesos conceptuales puede mejorar habilidades específicas, como la numeracidad.
El desafío principal sigue siendo evaluar el efecto del entrenamiento cognitivo. Una prueba ampliamente utilizada para medir el rendimiento cognitivo es el «Digit Symbol Substitution Test» (DSST), conocida por su brevedad, fiabilidad y mínima influencia de factores como el idioma o el nivel educativo. Sin embargo, persisten debates sobre qué aspectos específicos de la cognición mide esta prueba.
Este estudio se centra en la aplicación de Li-TMS a estudiantes universitarios para mejorar sus puntuaciones en pruebas cognitivas. El objetivo principal es evaluar el efecto de Li-TMS sobre el rendimiento cognitivo de los estudiantes universitarios. Las hipótesis que se probarán en este estudio son:
Hipótesis 1:
La estimulación placebo no produce cambios significativos en el rendimiento cognitivo medido por el DSST antes y después de la intervención en el grupo de control.
Hipótesis 2:
La estimulación magnética transcraneal de baja intensidad (Li-TMS) aumenta significativamente las puntuaciones del DSST después de la intervención en comparación con las mediciones de referencia en el grupo experimental.
Hipótesis 3:
El rendimiento cognitivo medido por el DSST será significativamente más alto en el grupo experimental después de la intervención, en comparación con los grupos pre-control, post-control y pre-experimental, sin diferencias significativas entre estos tres grupos.
Participantes y Diseño del Estudio:
El estudio incluyó a 30 estudiantes universitarios, 15 mujeres y 15 hombres, con un promedio de edad de 20.3 años. Todos los participantes eran estudiantes de segundo año de la Facultad de Medicina de la Universidad Nacional Autónoma de México (UNAM) y tenían un promedio de calificaciones de 9.0 o superior. Los participantes firmaron un consentimiento informado antes de comenzar el estudio.
El diseño del estudio fue un ensayo controlado aleatorio y ciego. Esto significa que los participantes fueron asignados de manera aleatoria a uno de dos grupos: el grupo experimental, que recibió sesiones de Li-TMS, y el grupo de control, que recibió una intervención placebo (una estimulación de baja intensidad). Cada grupo estaba compuesto por 15 participantes.
Intervención y Evaluación:
La intervención consistió en 10 sesiones diarias de estimulación magnética, realizadas de lunes a viernes, durante 10 días consecutivos. En el grupo experimental, se aplicó Li-TMS a la corteza prefrontal dorsolateral izquierda de los participantes a una intensidad de 50%, con una frecuencia de 25 Hz y una duración de 45 minutos por sesión. En el grupo de control, la intervención consistió en estimulación de baja intensidad (1% de intensidad y 1 Hz de frecuencia).
El rendimiento cognitivo de los participantes se evaluó antes y después de la intervención utilizando el Digit Symbol Substitution Test (DSST), una prueba neuropsicológica que evalúa funciones como la velocidad motora, la atención y las capacidades visuoperceptuales. Durante la prueba, los participantes deben asociar símbolos con números y reproducir tantas asociaciones correctas como sea posible en 60 segundos. Los puntajes se midieron en función de la cantidad de respuestas correctas obtenidas.
Resultados:
Los resultados mostraron que en el grupo control no hubo cambios significativos en las puntuaciones del DSST antes y después de la intervención. Esto sugiere que la estimulación placebo no tuvo efecto sobre el rendimiento cognitivo de los participantes.
Por otro lado, en el grupo experimental, donde se aplicó Li-TMS, se observó un aumento significativo en las puntuaciones del DSST después de la intervención. Este incremento fue estadísticamente relevante, lo que indica que Li-TMS tuvo un impacto positivo en el rendimiento cognitivo de los estudiantes.
Además, al comparar los resultados de ambos grupos (experimental y control), se encontró que las puntuaciones post-intervención del grupo experimental fueron significativamente más altas que las de los otros grupos: control pre-intervención, control post-intervención y experimental pre-intervención.
Discusión:
Los hallazgos de este estudio respaldan la idea de que la estimulación magnética transcraneal de baja intensidad (Li-TMS) puede ser efectiva para mejorar el rendimiento cognitivo en estudiantes universitarios. Este tipo de estimulación parece ser capaz de modular redes neuronales relacionadas con la atención, la velocidad de procesamiento y las funciones ejecutivas, lo que resulta en una mejora en tareas cognitivas específicas como la medida en este estudio con el DSST.
En comparación con otras intervenciones cognitivas, como los videojuegos diseñados para entrenar habilidades específicas, Li-TMS ofrece una ventaja significativa. Mientras que los videojuegos pueden producir mejoras en habilidades cognitivas y no cognitivas, estos efectos suelen ser inconsistentes y limitados en cuanto a su transferencia a tareas complejas o cotidianas. En cambio, Li-TMS ha demostrado ser capaz de inducir plasticidad sináptica y modular dinámicas corticales de forma focalizada, lo que permite un impacto más directo y robusto en las funciones cognitivas.
Además, los resultados obtenidos en este estudio son consistentes con investigaciones previas que han documentado los beneficios de Li-TMS en poblaciones con deterioro cognitivo, como pacientes con daño cerebral traumático, enfermedad de Alzheimer y deterioro cognitivo leve. Sin embargo, lo novedoso de este estudio es que demuestra la eficacia de Li-TMS en individuos sanos, ampliando así su potencial para su uso no solo en entornos clínicos, sino también en entornos educativos. Esto abre la puerta a su aplicación como una herramienta preventiva o para la optimización cognitiva en contextos académicos.
Conclusión:
El estudio demuestra que la estimulación magnética transcraneal de baja intensidad (Li-TMS) es una herramienta prometedora para mejorar el rendimiento cognitivo, especialmente en tareas relacionadas con la atención, la velocidad de procesamiento y las funciones ejecutivas, como se evidenció en los resultados del DSST. Los resultados destacan la efectividad de Li-TMS para mejorar el rendimiento cognitivo en estudiantes universitarios, sugiriendo que esta técnica podría ser una opción viable para la optimización cognitiva en entornos educativos. Esto abre nuevas posibilidades para futuras investigaciones y aplicaciones de Li-TMS en poblaciones sanas, con el potencial de complementar o incluso sustituir métodos tradicionales de entrenamiento cognitivo.
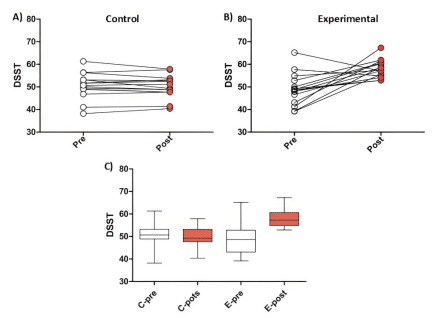
Figura 1. Efecto de la estimulación magnética transcraneal de baja intensidad (Li-TMS) sobre el rendimiento cognitivo medido por la prueba DSST.
A) Puntajes pre y post en el grupo de control: No se observaron diferencias significativas entre los puntajes antes y después de la intervención (p > 0.05, prueba de Wilcoxon).
B) Puntajes pre y post en el grupo experimental: Se observó un aumento significativo en los puntajes después de la intervención en comparación con los puntajes previos (p < 0.05, prueba de Wilcoxon).
C) Comparación de puntajes entre los grupos de control (C-pre, C-post) y los grupos experimentales (E-pre, E-post): Se encontró una diferencia significativa en los puntajes del grupo experimental post-intervención, que fueron significativamente más altos en comparación con todos los otros grupos (p < 0.05, prueba de Friedman con corrección post hoc de Bonferroni).
References
1. Mewborn C, Lindbergh CA, Miller LS. Cognitive interventions for enhancing executive function in older adults: A system- atic review and meta-analysis of recent studies. Psychol Aging. 2017 Mar;32(1):16 28. doi: 10.1037/pag0000148.
2. Shute VJ, Ventura M, Ke F. The power of play: The effects of Portal 2 and Lumosity on cognitive and noncognitive skills. Comput Educ. 2015;80:58-67. doi: 10.1016/j.compe du.2014.08.013.
3. Binet A, Simon T. The development of intelligence in chil- dren. L’Année Psychologique. 1905;12:191 244.
4. Bjorklund DF, Causey KB. Children’s Thinking: Cognitive De- velopment and Individual Differences. 6th ed. SAGE Publica- tions; 2018.
5. Merzenich MM, Kaas JH, Sur M. Progression of change fol- lowing median nerve section in the cortical representation of the hand in areas 3b and 1 in adult owl and squirrel mon- keys. Neuroscience. 1983;10(3):639-665. doi: 10.1016/0306 4522(83)90249-2.
6. Feuerstein R, Feuerstein RS, Falik LH. The Feuerstein Instrumental Enrichment Program. Educ Psychol Rev. 2010;22(1):89 101. doi: 10.1007/s10648-010-9138-7.
7. Kurzban R, Duckworth A, Kable JW, Myers J. An oppor- tunity cost model of subjective effort and task performance. Behav Brain Sci. 2013;36(6):661-679. doi: 10.1017/ S0140525X12003196.
8. Owen AM, Hampshire A, Grahn JA, Stenton R, Dajani S,Burns AS, et al. Putting brain training to the test: A randomized, controlled trial of cognitive training. Nature. 2010;465(7299):775-778. doi: 10.1038/nature09042.
9. Lampit A, Hallock H, Valenzuela M. Computerized cognitive training in cognitively healthy older adults: A systematic review and meta analysis of effect modifiers. PLoS Med. 2014;11(11). doi: 10.1371/journal.pmed.1001 56.
10. Melby-Lervåg M, Redick TS, Hulme C. Working memory training does not improve performance on measures of intelligence or other measures of “far transfer”: Evidence from ameta-analytic review. Perspect Psychol Sci.2016;11(4):512-534. doi: 10.1177/1745691616635612.
11. Morrison AB, Chein JM. Does working memory training work? The promise and challenges of enhancing cognition by training working memory. Psychon Bull Rev. 2011;18(1):46-60. doi: 10.3758/s13423-010 0034-0.
12. Sprague BN, Freed SA, Webb CE, Phillips CB, Hyun J, Ross LA. The impact of behavioral interventions on cognitive function in healthy older adults: A systematic review. Ageing Research Reviews. 2019 Jul;52:32-52. doi: 10.1016/j.arr.2019.04.002
13. Basak C, Qin S, O’Connell MA. Differential effects of cognitive training modules in healthy aging and mild cognitive impairment: A comprehensive meta analysis of randomized controlled trials. Psychol Aging. 2020 Mar;35(2):220249. doi: 10.1037/pag0000442.
14. Lefaucheur JP, Aleman A, Baeken C, Benninger DH, Brunelin J, Di Lazzaro V, et al. Evidence-based guidelines on the therapeutic use of repetitive transcranial magnetic stimulation (rTMS): An update (2014-2018). Clin Neurophysiol. 2020 Feb;131(2):474-528. doi: 10.1016/j.clinph.2019.11.0 2. Epub 2020 Jan 1. Erratum in: Clin Neurophysiol. 2020 May;131(5):1168-1169. doi: 10.1016/j.clinph.2020.02. 03.
15. Buzsáki G, Draguhn A. Neuronal oscillations in cortical networks. Science. 2004 Jun 25;304(5679):1926-9. doi: 10.1126/science.
16. Klimesch W, Sauseng P, Gerloff C. Enhancing cognitive performance with repetitive transcranial magnetic stimulation at human individual alpha frequency. Eur J Neu- rosci. 2003 Apr;17(6):1129–1133. doi: 10.1046/j.14609568.2003.02517.x.
17. Romei V, Driver J, Schyns PG, Thut G. Rhythmic TMS over parietal cortex links distinct brain frequencies to global versus local visual processing. Curr Biol. 2011 Feb;21(5):334 337. doi: 10.1016/j.cub.2011.01.035.
18. Tegenthoff M, Ragert P, Pleger B, Schwenkreis P, Förster AF, Dinse HR. Improvement of tactile discrimination performance and enlargement of cortical somatosensory maps after 5 Hz rTMS. PLoS Biol. 2005 Nov;3(11):e362. doi: 10.1371/journal.pbio.0030362.
19. Boyd LA, Linsdell MA. Excitatory repetitive transcranial magnetic stimulation to left dorsal premotor cortex enhances motor consolidation of new skills. BMC Neurosci. 2009 Jul;10(72):1471–2202. doi: 10.1186/1471-2202-10-72.
20. Bütefisch CM, Khurana V, Kopylev L, Cohen LG. Enhancing encoding of a motor memory in the primary motor cortex by cortical stimulation. J Neurophysiol. 2004 May;91(5):2110– 2116. doi: 10.1152/jn.01038.2003.
21. Tadin D, Silvanto J, Pascual-Leone A, Battelli L. Improved motion perception and impaired spatial suppression following disruption of cortical area MT/V5. J Neurosci. 2011 Jan;31(4):1279–1283. doi: 10.1523/JNEUROS- CI.4121-10.2011.
22. Oliveri M, Zhaoping L, Mangano GR, Turriziani P, Smirni D, Cipolotti L. Facilitation of bottom-up feature detection following rTMS-interference of the right parietal cortex. Neuropsychologia. 2010 Mar;48(4):1003–1010. doi: 10.1016/j. neuropsychologia.2009.11.20.
23. Bashir S, Mizrahi I, Weaver K, Fregni F, Pascual-Leone A. As- sessment and modulation of neural plasticity in rehabilitation 13 JONED. Journal of Neuroeducation – 5(2) https://revistes.ub.edu/ind x.php/joned/ February/febrero/febrer 2025 ISSN: 2696-2691 Sampieri-Cabrera, Oviedo, Pérez: Li-TMS Enhances cognitive performance Neuroeducational Research with transcranial magnetic stimulation. PM R. 2010 Apr;2(-Suppl. 2):S253S268. doi: 10.1016/j.pmrj.2010.03.021.
24. Emara TH, Moustafa RR, Elnahas NM, Roushdy TM, Elganzoury AM, AboulEzz HS, Hashem HM. Repetitive transcranial magnetic stimulation at 1 Hz and 5 Hz produces sustained improvement in motor function and disability after isch- aemic stroke. Eur J Neurol. 2010 Aug;17(9):1203–1209. doi: 10.1111/j.1468 1331.2010.03000.x.
25. Cicerone K, Levin H, Malec J, Stuss D, Whyte J. Cognitive rehabilitation interventions for executive function: moving from bench to bedside in patients with traumatic brain injury. J Cogn Neurosci. 2006 Jul;18(7):1212–1222. doi: 10.1162/ jocn.2006.18.7.1212.
26. Solé-Padullés C, Bartrés Faz D, Junqué C, Clemente IC, Moli- nuevo JL, Bargalló N, Bosch B, Sánchez-Valle R, Bernabeu M, Moral P. Repetitive transcranial magnetic stimulation effects on brain function and cognition among elders with memory dysfunction: A randomized sham controlled study. Cereb Cortex. 2006 Oct;16(10):1487–1493. doi: 10.1093/cercor/bhj083.
27. McKinley RA, Bridges N, Walters CM, Nelson J. Modulating the brain at work using noninvasive transcranial stimulation. Neuroimage. 2012 Jan;59(1):129–137. doi: 10.1016/j.neuroimage.2011.07.075.
28. Snyder AW. Explaining and inducing savant skills: privileged access to lower level, less-processed information. Philos Trans R Soc Lond B Biol Sci. 2009 Jun;364(1522):1399– 1405. doi:10.1098/rstb.2008.0290.
29. Boake C. From the Binet-Simon to the Wechsler-Bellevue: tracing the history of intelligence testing. J Clin Exp Neuropsychol. 2002;24(3):383–405. doi: 10.1076/jcen.24.3.383.981.
30. Wechsler D. The Measurement of Adult Intelligence. Baltimore, MD: The Williams & Wilkins Company; 1939.
31. Mewborn CM, Lindbergh CA, Stephen Miller L. Cognitive Interventions for Cognitively Healthy, Mildly Impaired, and Mixed Samples of Older Adults: A Systematic Review and Meta-Analysis of Randomized-Controlled Trials. Neuropsychol Rev. 2017 Dec;27(4):403-439. doi: 10.1007/s11065-017- 9350-8.
32. Shute VJ, Ventura M, KeF. The power of play: The effects of Portal 2 and Lumosity on cognitive and noncognitive skills. Comput Educ. 2015;80:58-67 . doi: 10.1016/j.compe du.2014.08.013.
33. Owen AM, Hampshire A, Grahn JA, Stenton R, Dajani S, Burns AS, et al. Putting brain training to the test: A randomized controlled trial of cognitive training. Nature. 2010;465(7299):775-778. doi: 10.1038/nature09042
34. Melby-Lervåg M, Redick TS, Hulme C. Working memory training does not improve performance on measures of intelligence or other measures of “far transfer”: Evidence from ameta-analytic review. Perspect Psychol Sci. 2016;11(4):512-534. doi: 10.1177/1745691616635612.
35. Morrison AB, Chein JM. Does working memory training work? The promise and challenges of enhancing cognition by training working memory. Psychon Bull Rev. 2011;18(1):46- 60. doi: 10.3758/s13423-010 0034-0.
36. Zhou L, Huang X, Li H, Guo R, Wang J, Zhang Y, Lu Z. Rehabilitation effect of rTMS combined with cognitive training on cognitive impairment after traumatic brain injury.Am J Transl Res. 2021 Oct 15;13(10):11711-11717. PMCID: PMC8581933.
37. Bagattini C, Zanni M, Barocco F, Caffarra P, Brignani D, Minius- si C, et al. Enhancing cognitive training effects in Alzheimer’s disease: rTMS as an add-on treatment. Brain Stimul. 2020 Nov-Dec;13(6):1655-1664. doi: 10.1016/j.brs.2020.09.010.
38. Jiang L, Cui H, Zhang C, Cao X, Gu N, Zhu Y, et al. Repetitive Transcranial Magnetic Stimulation for Improving Cognitive Function in Patients With Mild Cognitive Impairment: A Systematic Review. Front Aging Neurosci. 2021 Jan 14;12:593000. doi: 10.3389/fnagi.2020.59300 .
39. Beynel L, Appelbaum LG, Luber B, Crowell CA, Hilbig SA, Lim W, et al. Effects of online repetitive transcranial magnetic stimulation (rTMS) on cognitive processing: A meta-analysis and recommendations for future studies. Neurosci Biobehav Rev. 2019 Dec;107:47-58. doi: 10.1016/j.neubiorev.2019. 8.018.
40. Xie Y, Li Y, Nie L, Zhang W, Ke Z, Ku Y. Cognitive Enhancement of Repetitive Transcranial Magnetic Stimulation in Patients With Mild Cognitive Impairment and Early Alzheimer’s Disease: A Systematic Review and Meta-Analysis. Front Cell Dev Biol. 2021 Sep 10;9:734046. doi: 10.3389/fcell.2021.734046.
41. Antonenko D, Fromm AE, Thams F, Grittner U, Meinzer M, Flöel A. Microstructural and functional plasticity following repeated brain stimulation during cognitive training in older adults. Nat Commun. 2023 Jun 2;14(1):3184. doi: 10.1038/ s41467-023-38910-x.

