Stroke

Seguridad y Tolerabilidad de los Campos Magnéticos de Frecuencia Extremadamente Baja en el Accidente Isquémico Cerebral Agudo
Un estudio clínico abierto, de un solo brazo y de escalación de dosis está evaluando la seguridad y la tolerabilidad de los campos magnéticos de frecuencia baja (Li-TMS) en pacientes con accidente isquémico cerebral agudo (AICA). Este tipo de terapia utiliza campos magnéticos a frecuencias bajas (menos de 100 Hz) para estimular el cerebro, con el objetivo de mejorar la recuperación después de un derrame cerebral.
El estudio tiene como principal objetivo garantizar que la exposición a estos campos magnéticos sea segura para los pacientes. Se evaluarán los posibles efectos secundarios y cómo toleran los pacientes el tratamiento a diferentes intensidades de campos magnéticos. Además, se estudiarán los efectos de esta terapia en la función neurológica y la perfusión cerebral, con el fin de determinar si puede ayudar a la recuperación funcional de los pacientes.
Diseño del Estudio
Este ensayo se realizará con pacientes diagnosticados con un AICA dentro de las primeras 72 horas de ocurrido el evento. Los participantes recibirán terapia con Li-TMS durante cuatro semanas, con sesiones de 30 minutos, dos veces a la semana. La dosis se incrementará gradualmente para evaluar la seguridad de mayores niveles de exposición a los campos magnéticos.
Métodos
El estudio se llevó a cabo de acuerdo con la Declaración de Helsinki y fue aprobado por el comité ético local (Università Campus Bio-Medico di Roma) y el Ministerio de Salud de Italia. Se obtuvo el consentimiento informado de todos los participantes. El estudio fue registrado en ClinicalTrials.gov con el número NCT01941147 (9 de septiembre de 2013). El protocolo del estudio se ha publicado previamente.
Pacientes y la duración del tratamiento: Se planeó reclutar a 9 pacientes y tratarlos de acuerdo con el siguiente esquema de escalación de dosis: los primeros 3 pacientes recibirían 45 minutos al día de exposición; en ausencia de eventos adversos (EAs) observados, los siguientes 3 pacientes recibirían 120 minutos al día, y si no se observan EAs, los últimos 3 pacientes recibirían 240 minutos diarios. Debido a la naturaleza exploratoria de este estudio piloto, el tamaño de la muestra planeado no fue derivado estadísticamente.
Evaluación de la seguridad del ELF-MF
La seguridad del Li-TMS fue evaluada mediante el registro de la incidencia de eventos adversos (EAs) y mortalidad durante el período de estimulación y durante el seguimiento de un año. Se administraron cuestionarios sobre EAs diariamente durante toda la hospitalización y, después del alta, en cada visita de control. Además, durante la estimulación con Li-TMS, los pacientes fueron monitoreados continuamente mediante un monitor multimodal que evaluaba y mostraba simultáneamente los parámetros vitales relevantes (ECG, tasa respiratoria, frecuencia cardíaca, presión arterial y oximetría de pulso).
Evaluación de la tolerabilidad: La tolerabilidad de la estimulación se evaluó mediante el número de sujetos que solicitaron detener el tratamiento.
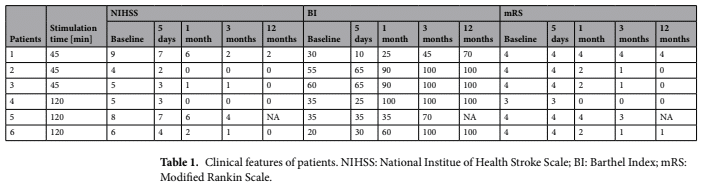
Evaluaciones clínicas: Las evaluaciones clínicas se realizaron mediante escalas internacionales validadas como la National Institutes of Health Stroke Scale (NIHSS), la Modified Rankin Scale (mRS) y el Barthel Index (BI). Los puntajes obtenidos en las visitas de seguimiento se compararon con los puntajes iniciales.
Imágenes de resonancia magnética (RM): Todas las imágenes de RM fueron obtenidas con un escáner de 1,5 T (Magnetom Symphony, Siemens Medical Systems, Erlangen, Alemania). Se realizaron las secuencias en el mismo orden, comenzando con un localizador sagital ponderado en T1: secuencia de eco de spin ponderada en T1 en el plano sagital, secuencia turbo spin-eco ponderada en T2 en el plano coronal, secuencia de imágenes ponderadas por difusión (DWI) en el plano axial y secuencia ponderada en T2 por Fluid-Attenuated Inversion Recovery (FLAIR) en el plano axial. La secuencia DWI se obtuvo con tres valores b de magnitud, de 0 a 1000 s/mm².
Medición cuantitativa del área isquémica volumétrica: Se calculó la medida cuantitativa del área isquémica volumétrica antes del tratamiento utilizando imágenes DWI con un valor b alto (1000 s/mm²), y después del tratamiento utilizando imágenes ponderadas en T2 FLAIR. El análisis de imágenes se realizó utilizando un software in-house escrito en Matlab R2007a (The MathWorks, Inc., Natick, MA, USA). El software se utilizó para medir los volúmenes de las lesiones isquémicas. Las áreas de las lesiones en cada sección se segmentaron mediante una herramienta de segmentación semiautomática basada en un método de imagen basado en regiones15, que implica la selección de puntos de semilla iniciales y luego examina los píxeles vecinos al punto de semilla para determinar si deben añadirse a la región, utilizando un umbral del 20% de la intensidad de señal del punto de semilla.
Un neurorradiólogo experto, cegado a las características clínicas, utilizó esta técnica semiaautomática para la identificación inicial de todas las lesiones, y luego se realizó una corrección manual de los bordes de las lesiones. El número de píxeles del área anómala de hiperintensidad segmentada se sumó automáticamente y se multiplicó por el grosor de la sección y el espaciamiento de los píxeles para calcular los volúmenes de las lesiones isquémicas agudas antes del tratamiento y de las lesiones isquémicas residuales después del tratamiento.
Evaluación de la tasa entre las regiones isquémicas volumétricas: Se calculó la tasa entre la región isquémica volumétrica evaluada en las imágenes T2 ponderadas FLAIR y en las imágenes DWI (relación FLAIR/DWI), además de la discrepancia volumétrica (FLAIR-DWI).16,17.
Resultados
Se reclutaron a siete pacientes (4 hombres; edad media: 76.3 ± 6.1). Una paciente (femenina, 85 años) retiró su consentimiento antes de la primera sesión de estimulación, por lo que no fue incluida en el análisis. Según el esquema de escalamiento de dosis, los primeros tres pacientes fueron estimulados durante 45 minutos al día, y los siguientes tres durante 120 minutos al día. Debido a la ausencia de eventos adversos (EAs), se propuso a los pacientes siguientes una exposición de 240 minutos al día, pero ninguno aceptó participar. De hecho, los pacientes consideraron que tal estimulación era demasiado larga y que podría interferir con el tratamiento estándar para el accidente cerebrovascular isquémico agudo, según los médicos tratantes. Seis pacientes completaron el período de tratamiento de 5 días y fueron incluidos en el análisis. De estos, cinco pacientes completaron el seguimiento de 12 meses, mientras que uno fue perdido en la visita de seguimiento a los 3 meses.
No se observaron EAs ni durante el tratamiento ni durante el seguimiento. Los parámetros vitales (tasa respiratoria, frecuencia cardíaca, presión arterial, oximetría de pulso y señal ECG) permanecieron estables durante la estimulación con Li-TMS. Ninguno de los pacientes requirió detener la sesión de tratamiento ni reportó incomodidad causada por la estimulación.
Evolución de condiciones clínicas
Las condiciones clínicas mejoraron en todos los pacientes (Tabla 1). Tal mejora fue ligeramente más evidente en el grupo estimulado durante un período más largo (120 minutos). La Tabla 2 muestra las mediciones volumétricas de las áreas isquémicas, evaluadas antes y después del tratamiento con Li-TMS. En el grupo estimulado durante 45 minutos, el volumen de la lesión aumentó en dos pacientes y se redujo en uno. En todos los pacientes estimulados durante 120 minutos, el volumen de la lesión isquémica se redujo.
Distribución del campo magnético
La distribución del campo magnético en la lesión isquémica y en el tejido cerebral circundante se estimó mediante estudios de simulación dosimétrica. La Figura 2 muestra los resultados de un paciente representativo en la cabeza completa, en la región isquémica y en tres cortes de volumen isquémico a distancias crecientes desde el centro de la bobina. Para cada paciente, se calcularon las distancias de la lesión isquémica a la bobina estimulante y el rango de campo magnético inducido en la misma (Tabla 2). La distancia varió de 1.6 cm a 6.7 cm, mientras que la intensidad del campo magnético inducido en la lesión isquémica varió de 1.0 a 2.2 mT. Luego, el volumen isquémico medido después del tratamiento con Li-TMS se superpuso a los resultados de dosimetría para correlacionar el cambio de volumen del área dañada con el campo magnético experimentado. No se encontró correlación entre la intensidad del campo magnético inducido en lesiones isquémicas individuales y la evolución de su volumen.
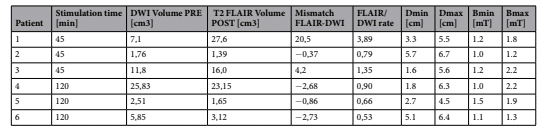
DWI Volume PRE: El volumen de la lesión isquémica antes del tratamiento en las imágenes de Difusión por Imágenes de Ponderación (DWI, por sus siglas en inglés).
T2 FLAIR Volume POST: El volumen de la lesión isquémica un mes después del tratamiento en las imágenes de FLAIR ponderadas en T2.
Mismatch FLAIR-DWI: La diferencia entre el volumen isquémico en las imágenes FLAIR después del tratamiento y el volumen isquémico en las imágenes DWI antes del tratamiento.
FLAIR/DWI Rate: La relación entre el volumen isquémico en las imágenes FLAIR después del tratamiento y el volumen isquémico en las imágenes DWI antes del tratamiento.
Dmin – Dmax: Las distancias mínima y máxima de la lesión isquémica desde la bobina de estimulación.
Bmin – Bmax: La intensidad mínima y máxima del campo magnético inducido en la lesión isquémica (medida en militeslas, mT).
Discusión
Hasta donde sabemos, este es el primer estudio que exploró la viabilidad de la estimulación con Li-TMS en pacientes con accidente cerebrovascular isquémico agudo. En un estudio previo con voluntarios sanos, demostramos que los Li-TMS no producen efectos secundarios en los humanos11. En este ensayo piloto, confirmamos que esta estimulación es segura y tolerable también en pacientes afectados por un accidente cerebrovascular agudo.
Durante el período de exposición de 5 días a Li-TMS, los parámetros vitales permanecieron estables y ninguno de los pacientes experimentó un deterioro neurológico (cambio en la puntuación NIHSS), reportó EAs, o requirió detener la estimulación por incomodidad. Estos datos fueron confirmados durante un largo período de seguimiento (12 meses). Todos los pacientes experimentaron una mejora progresiva de sus condiciones clínicas (cambio en las puntuaciones BI y mRS). La seguridad de la exposición a Li-TMS también se apoya en las imágenes de RM cerebral, que descartaron cualquier transformación hemorrágica de las lesiones isquémicas.
En cuanto al posible efecto de los Li-TMS sobre la evolución del tamaño de la lesión isquémica, la evolución normal del volumen del infarto en RM durante los primeros meses tras un accidente cerebrovascular es un tema debatido12,13. En nuestra muestra, observamos un aumento del infarto en 2 de 3 pacientes tratados durante 45 minutos por día, mientras que en el grupo estimulado durante 120 minutos, todos los pacientes mostraron una reducción del volumen isquémico. Estos hallazgos podrían sugerir que la exposición a Li-TMS durante un período adecuado influye en la evolución de la lesión isquémica hacia una reducción del volumen del infarto.
El estudio dosimétrico muestra que, en todos los pacientes, la intensidad máxima del campo magnético inducido en la lesión isquémica nunca fue inferior a 1 mT, el valor mínimo capaz de activar los receptores A2A en estudios preclínicos5,6. Además de los posibles efectos mediados por los receptores de adenosina, a estas intensidades, la exposición a ELF-MF podría ejercer una acción protectora directa contra la lesión hipóxica. En células similares a neuronas, esta estimulación restaura parcialmente la activación de HIF-1α (factor inducible por hipoxia-1) e inhibe la producción de ROS (especies reactivas de oxígeno) tras la incubación hipóxica. En células microgliales, reduce significativamente la generación de ROS y la liberación de citoquinas proinflamatorias, eventos cruciales en la exacerbación de la condición isquémica7.
Conclusión
El estudio ha demostrado que la estimulación Li-TMS es segura y tolerable en pacientes con accidente cerebrovascular agudo. Las principales preocupaciones de este estudio son la falta de un grupo tratado con placebo y el pequeño tamaño de la muestra de pacientes reclutados. Un estudio prospectivo, aleatorizado, controlado con placebo y doble ciego aclarará si los Li-TMS podrían representar un enfoque terapéutico potencial en el accidente cerebrovascular isquémico agudo.
Referencias
1. Moretti, A., Ferrari, F. & Villa, R. F. Neuroprotection for ischaemic stroke: current status and challenges. Pharmacol Ter. 146, 23–34
(2015).
2. Pedata, F. et al. Purinergic signalling in brain ischemia. Neuropharmacology. 104, 105–30 (2016).
3. Melani, A., Corti, F., Cellai, L., Vannucchi, M. G. & Pedata, F. Low doses of the selective adenosine A2A receptor agonist CGS21680
are protective in a rat model of transient cerebral ischemia. Brain Res. 10, 59–72 (2014).
4. Melani, A., Dettori, I., Corti, F., Cellai, L. & Pedata, F. Time-course of protection by the selective A2A receptor antagonist SCH58261
afer transient focal cerebral ischemia. Neurol Sci. 36, 1441–8 (2015).
5. Varani, K. et al. Efect of low frequency electromagnetic felds on A2A adenosine receptors in human neutrophils. Br J Pharmacol
136, 57–66 (2002).
6. Varani, K. et al. Efect of pulsed electromagnetic feld exposure on adenosine receptors in rat brain. Bioelectromagnetics. 33, 279–87 (2012).
7. Vincenzi, F. et al. Pulsed Electromagnetic Field Exposure Reduces Hypoxia and Inflammation Damage in Neuron-Like and
Microglial Cells. J Cell Physiol 232, 1200–1208 (2017).
8. Grant, G., Cadossi, R. & Steinberg, G. Protection against focal cerebral ischemia following exposure to a pulsed electromagnetic
feld. Bioelectromagnetics. 15, 205–16 (1994).
9. Pena-Philippides, J. C. al. Efect of Pulsed Electromagnetic Field (PEMF) on Infarct Size and Infammation Afer Cerebral Ischemia
in Mice. Transl Stroke Res 5, 491–500 (2014).
10. Di Lazzaro, V. et al. A consensus panel review of central nervous system efects of the exposure to low-intensity extremely low frequency magnetic felds. Brain Stimul. 6, 469–76 (2013).
11. Capone, F. et al. Does exposure to extremely low frequency magnetic felds produce functional changes in human brain? J Neural Transm 116, 257–65 (2009).
12. Kate, M. P. al. Dynamic Evolution of Difusion-Weighted Imaging Lesions in Patients With Minor Ischemic. Stroke. Stroke. 46,2318–21 (2015).
13. Ma, H. K. et al. Te hidden mismatch: an explanation for infarct growth without perfusion-weighted imaging/difusion-weighted imaging mismatch in patients with acute ischemic stroke. Stroke. 42, 662–8 (2011).
14. Capone, F. et al. An Open Label, One Arm, Dose Escalation Study to Evaluate Te Safety of Extremely Low Frequency Magnetic Fields in Acute Ischemic. Stroke. Austin J Cerebrovasc Dis & Stroke 1, 1–4 (2014).
15. Pratt, W. K., Digital Image Processing 4th Edition, John Wiley & Sons, Inc., Los Altos, California, (2007).
16. Desmond, P. M. et al. Te value of apparent difusion coefcient maps in early cerebral ischemia. AJNR Am J Neuroradiol 22, 1260–7 (2001).
17. Li, F., Silva, M. D., Sotak, C. H. & Fisher, M. Temporal evolution of ischemic injury evaluated with difusion, perfusion-, and T2-weighted MRI. Neurology. 54, 689–96 (2000).
18. Christ, A. et al. Te Virtual Family – Development of surface-based anatomical models of two adults and two children for dosimetric simulations. Physics in Medicine and Biology 55, N23–N38 (2010)
19. Kent, A.R., Grill, W.M. Analysis of deep brain stimulation electrode characteristics for neural recording Journal of Neural Engineering. 11, art. no. 046010 (2014).
Otras publicaciones



